Çinli bir bilim insanı ve Shenzhen’deki Güney Bilim ve Teknoloji Üniversitesi’nde araştırmacı olan He Jiankui, 2018’in Kasım ayında ilk kez genetik müdahalede bulunulmuş insan bebeklerinin doğduğunu ilan etti. He’nin iddiasına göre HIV’nin (İnsan İmmün Yetmezlik Virüsü - AIDS hastalığına sebep olan virüs) hücreleri enfekte etmek için kullandığı genetik yolu, embriyolarda devre dışı bırakarak AIDS hastalığına bağışıklığı bulunan bebekler doğmasını sağlamış oldu. He Jiankui, bebeklerin DNA dizilemesinin gerçekleştirildiğini, genetik müdahalenin başarılı olduğunu ve sadece hedef genin değiştirildiğini söyledi. Fakat bu çalışmanın hakemli bilimsel bir dergide yayınlanmamış ya da bağımsız genom testi ile doğrulanmamış olması, çalışma ile ilgili etik soruların yanına bilimsel soruların da eklenmesine sebep oldu. Bilim dünyasında hem heyecan hem de öfke uyandıran bu tartışmalı çalışmaya yönelik sorularımızı Dokuz Eylül Üniversitesi Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı'ndan Prof. Dr. Oğuz Altungöz'a yönelttik.
Merhaba hocam. İlk olarak genomun, genetik müdahalenin ne olduğunu açıklamanız mümkün mü?
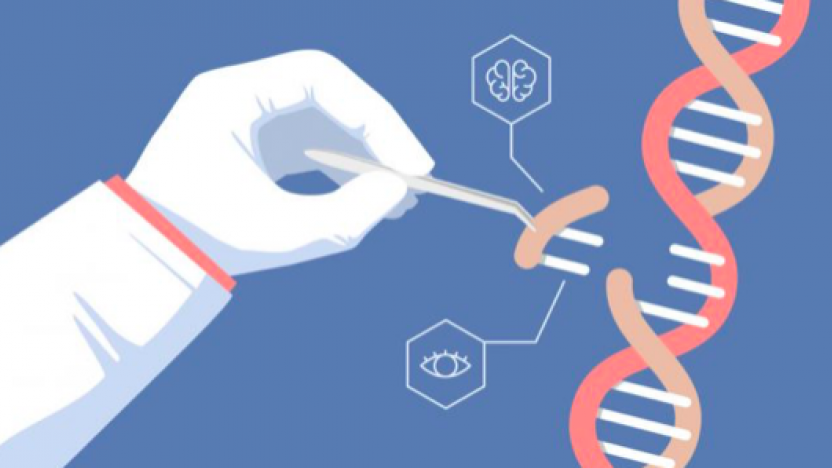
Genetik materyalin tamamını genom olarak adlandırıyoruz. Tüm organizmaların genomu çeşitli hücresel işlevleri belirleyen çok sayıda gen içermektedir. Örneğin insan genomunda yaklaşık 20 bin gen bulunmaktadır. Bireyler arasındaki göz rengi, ten rengi, boy, hastalıklara yatkınlık ya da direnç gibi çok sayıda fenotip farklılıkları bu genlerdeki nicel ya da nitel farklılıklardan kaynaklanır. Genler, her bir kromozomun yapısındaki çok uzun ve kesintisiz DNA molekülünün üzerinde bulunan bölgesel DNA dizileridir. Bu dizinin alfabesini oluşturan A, T, G ve C harflerinin ardışık dizilimi tüm organizmaların bireyleri arasında farklılık gösterir. Bazen de bu farklılık harflerin dizilimi değil de belli bir parçanın kopya sayısı şeklinde olabilir. Belli genlerde gözlenen bazı dizi ya da kopya sayısı değişiklikleri genetik hastalıklara neden olur. Örneğin distrofin genindeki belli bölgelerin yitimi (sayısal kaybı) bir kas hastalığı olan “Duchenne musküler distrofisi”ne yol açar. Benzer şekilde kırmızı kan hücrelerinde bulunan ve oksijen taşınmasından sorumlu hemoglobin molekülünün beta-zincirini kodlayan gendeki özgül bir DNA dizi değişikliği (GAG yerine GTG) “orak hücre anemisi”ne yol açar.
Sohbetimize konu olan genetik müdahaleden, yani genom düzeltmesinden, bölünerek embriyoyu oluşturacak olan ilk hücrenin (zigot) genetiğine müdahale ederek belli bir bölgesindeki DNA dizisini değiştirmeyi anlıyoruz. Bu müdahale belli bir hastalığa yol açan bir kusuru düzeltmek amacıyla yapılabileceği gibi, belli genler tarafından kodlanan bir özelliği kazandırmak amaçlı da olabilir. Yakın zamana kadar bu mümkün değildi. Genom bilim ve hücre biyolojisi alanında son on yılda edinilen bilgi birikimi hücrenin genomuna müdahale etmeyi mümkün hale getiren teknolojilerin ortaya çıkmasını sağlamış oldu.
Bu türden genomda değişiklik yapmayı hedefleyen yöntemler yaygın olarak hücre hattı veya deney hayvanı modellerinde genlerin işlevlerini anlamaya yönelik olarak kullanılmaktadır. Klasik anlamda genetik, anomaliden yola çıkarak normali anlamanın bilimidir. Geçmişte, doğanın yaptığı anormal fenotipe yol açan kusurları anlamaya çalışıyorduk. Günümüzde, bu teknolojilerden faydalanarak belli bir gen bölgesinde mutasyon oluşturup ortaya çıkan fenotipten hareketle o genin işlevi araştırılabiliyor. Ancak, bu tür teknolojilerin henüz insan üzerinde tıbbi amaçlı kullanımı son derece sınırlıdır. Bunun çok çeşitli nedenleri var elbette.
Peki, bu özel durumda kullanılan yöntemin detaylarıyla ilgili bilgi verebilir misiniz?
DNA sarmalı her biri riboz-fosfat omurgasından oluşan iki iplikten oluşmaktadır. Bir genin işlevini bozmak için o gen bölgesinde “DNA çift-iplik kırığı” oluşturmak gerekir. Bu türden kırıklar hücre için zararlı olduğundan, hücrelerde bu tür DNA hasarlarının onarılmasını sağlayan onarım yolakları evrimleşmiştir. Hücre çift-iplik kırıklarını onarmak için kırığı iki ucundan kırparak uçları birleştirir. Aradan parça uzaklaşmış olacağından, genellikle bu tür bir hasar onarımı genin işlevini ortadan kaldırır.
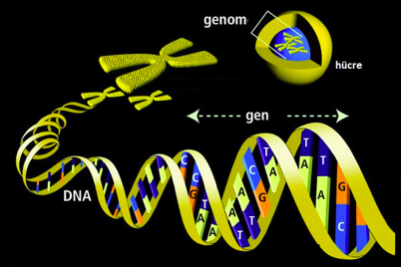
Araştırmacılar çift-iplik DNA kırkları oluşturan ve nükleaz olarak isimlendirilen enzimlerin, istenilen özgül bir bölgeyi hedefleyeceği yöntemlerin arayışına girmiştir. Bu arayış sırasında başka bir alanda (bakteri genetiğinde) bir gelişme olmuş ve bir rehber RNA tarafından ilgili bölgeye hedeflenen bir nükleaz sisteminin, bakterilerin ve arkeaların bağışıklık sisteminden sorumlu olduğu bulunmuştur. Bağışıklık sistemi, bakterileri enfekte edip öldüren virüslerden korunmayı sağlayacak şekilde evrimleşmiştir. Bu, “CRISPR-Cas9” sistemi olarak adlandırılmaktadır.
Bakteri, kendisini istila eden virüs genomlarının bir parçasını kesip kendi genomunda, CRISPR dizileri denen, ardışık tekrarlı dizilerin arasına entegre etmektedir. Böylece bakteri istilacı genetik materyallerin bir hücresel belleğini oluşturmaktadır. Sonra bu viral kökenli DNA kalıbından hedefi buldurmaya yarayan bir rehber RNA sentezlenmektedir. Bu rehber RNA Cas9 protein kompleksini hedefe, yani virüs genomuna yönlendirmekte ve nihayet hedeflenen virüs DNA’sı Cas9 enzimlerinin aracılığı ile kesilip etkisiz hale getirilmektedir.
Bakteri dünyasında böyle bir “edinsel bağışıklık sistemi”nin varlığı yakın zamana kadar bilinmemekteydi. 2012 yılın Jennifer Doudna and Emmanuelle Charpentier isimli iki bilim insanı bakterideki CRISPR-Cas9 sistemini laboratuvar ortamında modifiye etti. Sentetik olarak elde edilen rehber RNA, hayvan hücrelerinin genomunda istenilen bölgeyi hedefleyecek şekilde programlanabilmektedir. Rehber RNA ve Cas9 bileşenlerinden oluşan moleküler yapı, rehber RNA aracılığı ile genom içerisindeki hedefi bulmakta, Cas9 proteini aracılığı ile özgül noktadan DNA’yı kesmektedir. Hücre için toksik olan çift-iplik kırığı, daha önce söz ettiğimiz uç birleştirme yöntemine ilaveten, sağlam DNA kopyasını kalıp olarak kullanarak da onarılmaktadır. Buna HDR, yani “homolog aracılıklı onarım” denilmektedir. Her insanda, anne ve babadan gelen iki kopya gen olduğunu hatırlayalım. Yani, diyelim anneden kusurlu gen kopyası geldi. CRISPR-Cas9 ile bunu hedefleyip kesiyoruz. Sonra hücre babadan gelen sağlıklı gen kopyasını kalıp olarak kullanıp burayı onarıyor. Kalıp, sentetik DNA olarak hücreye dışardan da verilebiliyor. Böylece mutasyonu embriyonun en erken evresi olan zigotta düzeltmek mümkün oluyor.
Bu noktada şu sorulabilir: “Hücrede DNA kırığının iki yöntemden hangisiyle onarılacağına nasıl karar veriliyor?” Bu hücrenin hangi evrede olduğuna bağlı. Bölünme öncesi DNA sentezinin yapıldığı evrede, oluşturulan DNA hasarı homolog kalıba göre düzeltiliyor. Hücrenin normal biyolojisi böyle. Bu nedenle gen düzeltmesi amaçlı müdahale hücre kendi DNA’sını sentezlerken yapılıyor.
Beş yıl önce geliştirilen CRISPR-Cas9 yöntemi yaygın olarak kullanılan bir genetik müdahale biçimi oldu. Birçok canlıda, özellikle farelerde, farklı genler için kullanılmış, beyin fonskiyonlarına müdahale edilerek öğrenmeyi hızlandırma ya da bulaşıcı hastalık virüslerinden korunma sağlama gibi canlının yaşam kalitesini arttırıcı yönde gelişmeler kaydedilebileceği gösterilmiştir. Peki, bu iyileştirmelerin yanı sıra bu yöntemin dezavantajları bulunmakta mıdır? Yoksa dilediğimiz gibi genlerle oynanıp tüm sağlık problemlerinin üstesinden gelmek gerçekten mümkün müdür?
Genetik kodu yapay olarak değiştirmeye yönelik müdahale beraberinde iki temel sorunu barındırıyor. Birincisi yöntemin biyolojisine ve şu anki sınırlılıklarına ilişkin. Hücreye CRISPR-Cas9 sistemi gönderildiğinde, hedeflenen nokta dışında başka genlerde de istenmeyen değişikliklerin oluşabilmesi. Bu tehlikeli bir durum. Örneğin kanser gibi hastalıklara neden olan zararlı mutasyonlar oluşabiliyor. Tabi bu durumun aşılması için çok sayıda çalışma var. Biyo-mühendislik çalışmalarıyla Cas9’un yapısı değiştirerek özgüllüğünün artırılması sağlanabiliyor. Örneğin çift-iplik kırığı yapan tek bir Cas9 yerine, aynı noktada DNA’nın her bir ipliğinde tek kırık yapan iki Cas9 molekülü kullanmak, hedef dışındaki bölgelerde değişiklik oluşması olasılığını azaltıyor. İki iplikten her birini hedefleyen farklı rehber RNA’lar kullanıldığı için özgüllük artıyor.
İkincisi de hedef dışı değişikliklerin kalıtım yoluyla sonraki kuşaklara da aktarılmasına ilişkin olası sorunlar. Yani aynı zamanda toplumdaki gen havuzuna da müdahale edilmiş oluyor. Popülasyonda her genin alternatif formlarının, yani alellerinin belli sıklıkları var. Genlerin alel sıklıkları sürekli devinim içinde ve canlıların evrilmesinde rol oynuyor. Bu anlamda kalıtım materyaline kuşaktan kuşağa aktarılabilir bir müdahale, aynı zamanda popülasyonun genetiğine de müdahale anlamına geliyor. Aynı durum bitki ve hayvan ıslahı amacıyla yapılan uygulamalar için de geçerli.
Çinli bilim insanının müdahalesiyle ise yöntem ilk kez insan üzerinde denenmiş oldu ve dünya çapında bir etik tartışması da baş gösterdi. Bunun sebepleri nedir? Tartışmanın tarafları ne söylüyor?
Tıp etiği ve genetik etiği alanının en temel kuralı “primum non nocere” yani “zarar vermekten kaçınma” ilkesi. Genom müdahalesi sonrasında yeni kuşak DNA dizilme yöntemiyle yapılan çalışmalar çok sayıda hedef dışı değişikliklerin olabildiğini gösteriyor. Yani, henüz gelinen noktada deyim yerindeyse “kaş yapayım derken göz çıkartmak” son derece olası.
Bir diğer nokta genom düzeltmesinin “hangi amaçla” uygulanacağı. Yalnızca genetik hastalıkları bertaraf etmek için mi kullanılacak? Ya da sizin de bir önceki soruda değindiğiniz gibi bilişsel veya motor becerileri iyileştirmek için kullanımı etik mi? Dahası, bundan kimler yararlanacak? Tıbbi endikasyon olan durumlar hangi ilkelere göre sağlık güvencesi kapsamına alınacak? Tüm bu sorular etiğin “adalet” yönüne ilişkin sorunsallar. Ben bu genetik teknolojinin insanlar arasındaki sosyal eşitsizliği daha da derinleştireceği görüşündeyim.
Öngörülerimizi daha ileri bir noktaya taşıyabiliriz. Genom düzeltmesi ile ilgili teknik sorunlar çözüldüğünde, çoklu-lokus uygulamaları gündeme gelecektir. Yani birden fazla gene müdahale ve tabi tasarlanmış bebekler. Böyle bir hizmet alanı olması durumunda, bu hizmeti satın alma gücü olmayan kesimler açısından büyük bir eşitsizlik doğacaktır. Tabi bir de tasarlanmış bireylerle doğal yollardan doğan bireyler arasında oluşabilecek eşitsizlik var.
He’nin iddiasına göre genetik müdahaleye uğramış bebekler HIV virüsüne yani AIDS hastalığına bağışıklığı olarak dünyaya geldiler. Birçok araştırmacıya göre bu muazzam bir durum ve oluşabilecek ufak birkaç yan etkiyi göz ardı etmeye değer bir sonuç. Bir bilim insanı olarak siz ne düşünüyorsunuz?
Çinli bilim insanı He Jiankui’nin yöntemsel olarak ne yaptığını tam bilmiyoruz. Çünkü bu uygulama, yöntemi ve bulguları hakemli bir dergide yayınlanmış bir çalışma değil. Çalışmasını geçtiğimiz Kasım ayında Honk Kong’da bir Genom Toplantısı’nda sundu yalnızca. Bu tür çalışmaları yapabilmek için “etik kurul” izinleri ve katılımcıların “bilgilendirilmiş gönüllü onayı” gerekiyordu. Çeşitli kaynaklarda görebildiğim kadarıyla klinik çalışma için herhangi bir “akademik etik kurul” başvurusu yok. Bu yüzden biyo-etikçiler dahil ilgili bilim çevreleri bu girişimi kınadı. Ama bilim ve tıp tarihi açısından yüzyılın olayı diye düşünüyorum. İnsanlık tarihinde ilk kez genetiği değiştirilmiş bebekler dünyaya geldi.
He, CCR5 genini değiştirdiğini iddia ediyor. CCR5 geni, beyaz kan hücrelerinin yüzeyinde bulunan bir reseptör proteini kodluyor. HIV virüsü bu reseptör aracılığı ile T-hücrelere giriyor. Bu genin nadir alternatif formu olan CCR5 Delta32 alelinin HIV virüsüne karşı direnç sağladığı biliniyor. He, CRISPR-Cas9 yöntemini kullanarak in vitro fertilizasyon embriyolarında bu değişikliği yaptığını açıkladı. Ancak HIV virüsünün mutasyon geçirmiş formlarının hücreye girmek için CCR5 dışında farklı reseptörleri kullandığı da biliniyor. Bu durumda He’nin CCR5 geninde yaptığı düzeltme ikiz kızlarda HIV’e karşı tam bir koruma sağlamayacaktır.
Bir de tabi insanda genom düzeltmesi girişimlerinin uzun erimli sonuçlarına yönelik hiçbir veri bulunmuyor. Bu yönden bakıldığında He “primum non nocere” etik ilkesini ihlal etmiş gözüküyor. Bir de henüz CRISPR-Cas9 yönteminin insan embriyosunda uygulanmasına yönelik yeterince öncül deneysel çalışma olmaması da sorunlu bir durum. İnsan embriyosunda daha önce yapılmış yalnızca iki deneysel çalışma var. Bu iki çalışmada kısmi bir başarı elde edildi.
Teşekkür ederiz…